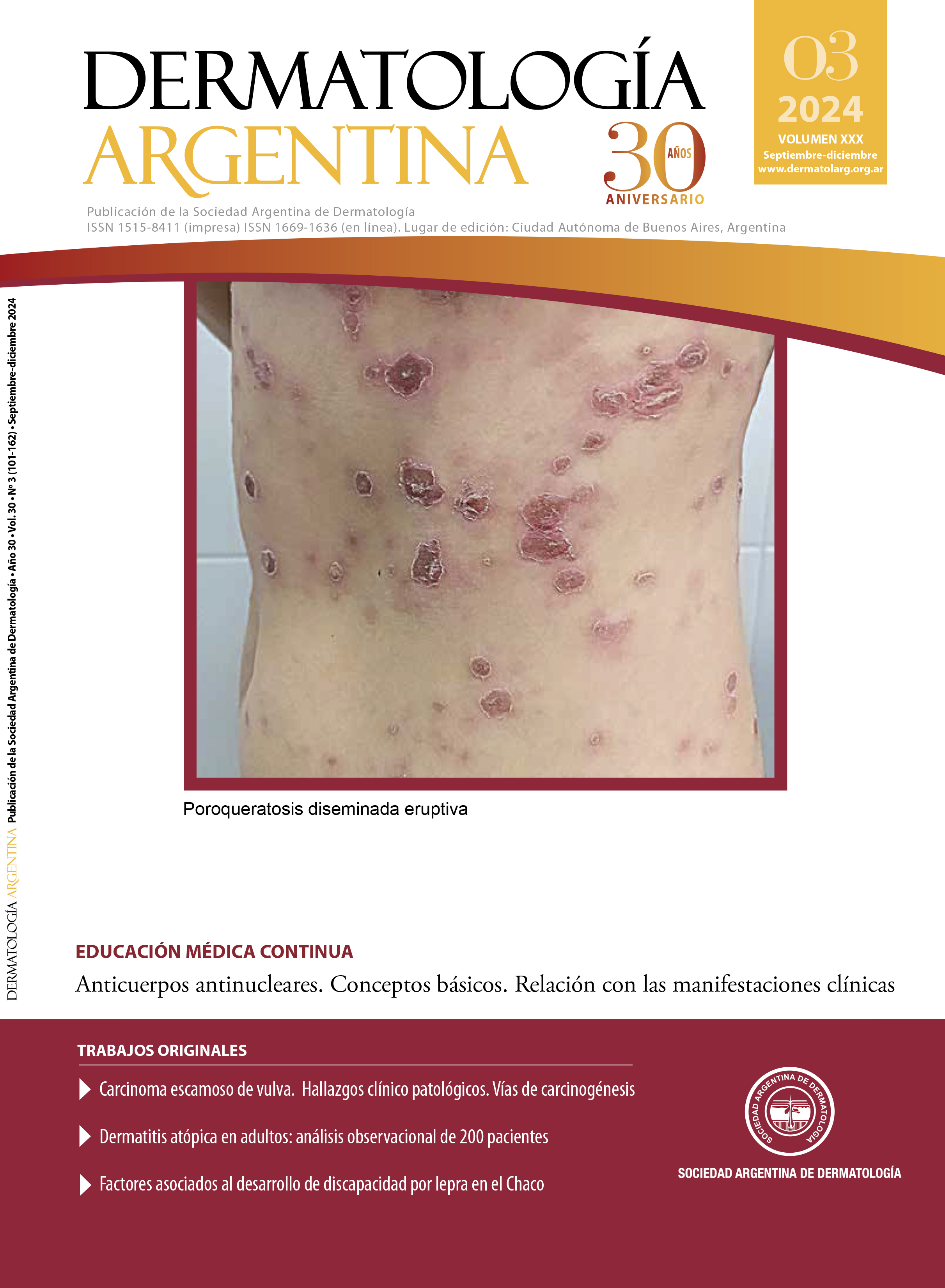
Carcinoma escamoso de vulva. Hallazgos clínico patológicos. Vías de carciogénesis
DOI:
https://doi.org/10.47196/da.v30i3.2667Palabras clave:
carcinoma escamoso vulvar, inmunohistoquímica, virus de papiloma humano, liquen escleroso, p16, p53Resumen
El carcinoma escamoso vulvar (CEV) se puede desarrollar asociado o no a la infección por el virus de papiloma humano (VPH). El objetivo del trabajo fue evaluar la concordancia entre la clínica, la histología, el inmunofenotipo, el tratamiento y la evolución de 17 casos estudiados en los Servicios de Patología, Ginecología y Dermatología del Hospital Penna de Buenos Aires. El estudio inmunohistoquímico mostró un patrón p16 +/p53 wild type (wt) (8/17), p16-/p53 mutado (7/17) y p16-/p53 wt (2/17). Los estadios (E) en el grupo p16+ fueron: E-I (4 pacientes [pac.]), E-II (1 pac.E-III (2 pac.) y E-IV (1 pac.); en el grupo p16- fueron: E-II (2 pac.), E-III (6 pac.) y E-IV (1 pac.). La subdivisión de los CEV en subgrupos clínicos de acuerdo con la expresión de p16 y p53 permite entender la evolución. Se recomienda implementar este estudio en la rutina del diagnóstico patológico de los CEV.
Citas
I. Olawaiye AB, Cuello MA, Rogers LJ. Cancer of the vulva: 2021 update. Int J Gynaecol Obstet. 2021;155:7-18.
II. Siegel RL, Miller KD, Wagle NS, Jemal A. Cancer statistics 2023. CA Cancer J Clin. 2023;73:17-48.
III. Sistema de Vigilancia Epidemiológica y Reporte del Cáncer. Boletín de mortalidad por cáncer en Argentina. SIVER-Ca con base de datos de la DEIS. Ministerio de Salud. Consultado: septiembre 2023.
IV. Wohlmuth C, Wohlmuth-Wieser I. Vulvar malignancies: an interdisciplinary perspective. J Dtsch Dermatol Ges. 2019;17:1257-1276.
V. Tan A, Bieber AK, Stein JA, Pomeranz MK. Diagnosis and management of vulvar cancer. A review. J Am Acad Dermatol. 2019;81:1387-1396.
VI. Asociación Argentina de Ginecología Oncológica. Guías clínicas para el diagnóstico, tratamiento y seguimiento del cáncer genital femenino. 3º Edición. Editorial Ascune 2016. Capítulo: Cáncer de vulva:129-148.
VII. Oonk MHM, F, Baldwin P, Mahner S, et ál. European society of gynaecological oncology guidelines for the management of patients with vulvar cancer update 2023. Int J Gynecol Cancer. 2023;33:1023-1043.
VIII. Höhn AK, Brambs CE, Hiller GGR, May D, et ál. 2020 WHO Classification of female genital tumors. Geburtshilfe Frauenheilkd. 2021;81:1145-1153.
IX. Falcón MF, Paradeda ME, Kamermann FG, Maldonado V, et ál. Immunohistochemistry of p16 and p53 in vulvar cancer. Medicina (B Aires). 2020;80:127-133.
X. Boyle W, Ganesan R. Vulval carcinomas. An update. Diagnostic Histopathology. 2021;27:472-477.
XI. Barlow EL, Lambie N, Donoghoe MW, Naing Z, et ál. The clinical relevance of p16 and p53 status in patients with squamous cell carcinoma of the vulva. J Oncol. 2020;3739075.
XII. Woelber L, Prieske K, Eulenburg C, Oliveira-Ferrer L, et ál. p53 and p16 expression profiles in vulvar cancer: a translational analysis by the Arbeitsgemeinschaft Gynäkologische Onkologie Chemo and Radiotherapy in Epithelial Vulvar Cancer study group. Am J Obstet Gynecol. 2021;224:595.e1-595.e11.
XIII. Kortekaas KE, Bastiaannet E, van Doorn HC, de Vos van Steenwijk PJ, et ál. Vulvar cancer subclassification by HPV and p53 status results in three clinically distinct subtypes. Gynecol Oncol. 2020;159: 649-656.
XIV. Tessier-Cloutier B, Kortekaas KE, Thompson E, Chen J, et ál. Major p53 immunohistochemical patterns in in situ and invasive squamous cell carcinomas of the vulva and correlation with TP53 mutation status. Mod Pathol. 2020;33:1595- 1605.
XV. Van den Brule AJ, Pol R, Fransen-Daalmeijer N, Schouls LM, et ál. GP5+/6+ PCR followed by reverse line blot analysis enables rapid and high-throughput identification of human papillomavirus genotypes. J Clin Microbiol. 2002;40:779-87.
XVI. Bermejo A, Rodríguez EA, Leiro V, Mestroni M, et ál. Consenso sobre virus papiloma humano (HPV) y herpes simplex virus (HSV) 2016. Sociedad Argentina de Dermatología. Disponible en: www.sad.org.ar/wpcontent/uploads/2016/04/Consenso-HPV-y-HSV-2016 pdf. Consultado marzo de 2024.
XVII. Osuna-Marco M, López- Barahona M, López-Ibor B, Tejera Á. Ten reasons why people with down syndrome are protected from the development of most solid tumors. A review. Front Genet. 2021;12:1-12.
XVIII. De Luca D, Papara C, Vorobyev A, Staiger H, et ál. Lichen sclerosus: the 2023 update. Front Med. 2023;10:1-20.
XIX. Day T, Selim A, Allbritton J, Scurry J. Nonsclerotic lichen sclerosus: definition of a concept and pathologic description. J Low Genit Tract Dis. 2023;27:358-364.
XX. Saunders H, Buchanan JAG, Cooper S, Hollowood K, et ál. The period prevalence of oral lichen planus in a cohort of patients with vulvar lichen sclerosus. JEADV 2010;24:18-21.
Descargas
Publicado
Número
Sección
Licencia
Derechos de autor 2024 a nombre de los autores. Derechos de reproducción: Sociedad Argentina de Diabetes

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial-SinDerivadas 4.0.
El/los autor/es tranfieren todos los derechos de autor del manuscrito arriba mencionado a Dermatología Argentina en el caso de que el trabajo sea publicado. El/los autor/es declaran que el artículo es original, que no infringe ningún derecho de propiedad intelectual u otros derechos de terceros, que no se encuentra bajo consideración de otra revista y que no ha sido previamente publicado.
Le solicitamos haga click aquí para imprimir, firmar y enviar por correo postal la transferencia de los derechos de autor